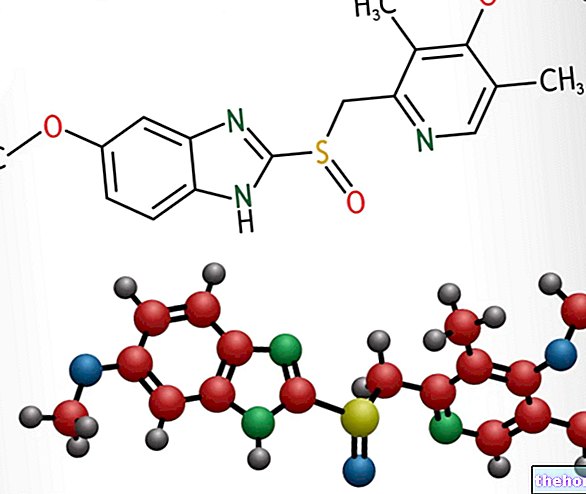
Vaikuttavat aineet: Atorvastatiini
TORVAST 10 mg kalvopäällysteiset tabletit
TORVAST 20 mg kalvopäällysteiset tabletit
TORVAST 40 mg kalvopäällysteiset tabletit
TORVAST 80 mg kalvopäällysteiset tabletit
Torvast -pakkausselosteita on saatavana seuraaville pakkauskoille: - TORVAST 10 mg kalvopäällysteiset tabletit, TORVAST 20 mg kalvopäällysteiset tabletit, TORVAST 40 mg kalvopäällysteiset tabletit, TORVAST 80 mg kalvopäällysteiset tabletit
- TORVAST 5 mg purutabletit, TORVAST 10 mg purutabletit, TORVAST 20 mg purutabletit, TORVAST 40 mg purutabletit
Käyttöaiheet Miksi Torvastia käytetään? Mitä varten se on?
TORVAST kuuluu statiinien lääkeryhmään, joka säätelee lipiditasoja.
TORVASTia käytetään veren lipiditasojen, kolesterolin ja triglyseridien, alentamiseen, kun vähärasvainen ruokavalio ja elämäntapamuutokset eivät ole onnistuneet. Jos sinulla on suuri sydän- ja verisuonisairauksien riski, TORVASTia voidaan käyttää myös tämän riskin pienentämiseen, vaikka kolesterolitasosi olisi normaali. Tavallista ruokavaliota kolesterolin alentamiseksi tulee jatkaa hoidon aikana.
Vasta -aiheet Milloin Torvastia ei tule käyttää
Älä ota TORVASTia
- jos olet yliherkkä (allerginen) atorvastatiinille tai jollekin lääkkeelle, jota käytetään veren lipiditasojen alentamiseen, tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa 6).
- jos sinulla on tai on ollut maksasairaus
- jos maksan toimintakokeiden tulokset ovat osoittaneet selittämättömästi muuttuneita arvoja
- jos olet hedelmällisessä iässä oleva nainen etkä käytä luotettavaa ehkäisymenetelmää
- jos olet raskaana tai suunnittelet raskautta
- jos imetät
Käyttöä koskevat varotoimet Mitä sinun on tiedettävä, ennen kuin otat Torvast -valmistetta
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin otat TORVAST -valmistetta
Alla on syitä, miksi TORVAST ei ehkä sovi sinulle:
- jos sinulla on aiemmin ollut aivohalvaus ja aivoverenvuoto tai jos sinulla on aivoissa alhaiset nestevarat aiempien aivohalvausten vuoksi
- jos sinulla on munuaisongelmia
- jos sinulla on heikosti toimiva kilpirauhanen (kilpirauhasen vajaatoiminta)
- jos sinulla on ollut toistuvaa tai selittämätöntä lihaskipua, sinulla tai sinulla on ollut lihasongelmia
- jos sinulla on aiemmin ollut lihasongelmia muiden lipidejä alentavien lääkkeiden (esim. muiden statiini- tai fibraattiluokkien lääkkeiden) käytön aikana
- jos käytät säännöllisesti suuria määriä alkoholia
- jos sinulla on ollut maksasairaus
- jos olet yli 70 -vuotias
Tarkista lääkäriltäsi tai apteekista ennen TORVASTin ottamista
- Jos sinulla on vaikea hengitysvajaus
Jos jokin näistä koskee sinua, lääkärisi on tehtävä verikoe ennen TORVAST-hoitoa ja mahdollisesti sen aikana, jotta voidaan ennustaa lihakseen liittyvien sivuvaikutusten riski. Lihakseen liittyvien sivuvaikutusten (esim. Rabdomyolyysi) riskin tiedetään kasvavan, kun tiettyjä lääkkeitä otetaan samanaikaisesti (ks. Kohta 2 "Muut lääkevalmisteet ja TORVAST")
Tällä lääkkeellä hoidon aikana lääkäri tarkistaa huolellisesti, ettei sinulla ole diabetes tai että sinulla ei ole diabeteksen kehittymisriskiä. Sinulla on riski sairastua diabetekseen, jos sinulla on korkea verensokeri- ja rasvapitoisuus, jos olet ylipainoinen ja korkea verenpaine.
Yhteisvaikutukset Mitkä lääkkeet tai elintarvikkeet voivat muuttaa Torvastin vaikutusta
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä. Jotkut lääkkeet voivat muuttaa TORVASTin vaikutusta tai TORVAST voi muuttaa näiden lääkkeiden vaikutusta. Tämäntyyppinen vuorovaikutus voi heikentää yhden tai molempien lääkkeiden vaikutusta.Vaihtoehtoisesti se voi lisätä sivuvaikutusten riskiä tai vakavuutta, mukaan lukien rabdomyolyysiksi kutsuttu lihasten heikkeneminen, joka on kuvattu kohdassa 4:
- Lääkkeet, joita käytetään immuunijärjestelmän toiminnan muuttamiseen, esim. syklosporiini
- Jotkut antibiootit tai sienilääkkeet, esim. erytromysiini, klaritromysiini, telitromysiini, ketokonatsoli, itrakonatsoli, vorikonatsoli, flukonatsoli, posakonatsoli, rifampisiini, fusidiinihappo
- Muut lipiditasojen säätelyyn käytettävät lääkkeet, esim. gemfibrotsiili, muut fibraatit, kolestipoli
- Jotkut kalsiumkanavan salpaajat, joita käytetään angina pectoriksen tai korkean verenpaineen hoitoon, esim. Amlodipiini, diltiatseemi; sydämen rytmiä säätelevät lääkkeet, esim. Digoksiini, verapamiili, amiodaroni
- HIV: n hoitoon käytettävät lääkkeet, esim. Ritonaviiri, lopinaviiri, atatsanaviiri, indinaviiri, darunaviiri, tipranaviirin ja ritonaviirin yhdistelmä jne.
- Jotkut hepatiitti C: n hoitoon käytetyt lääkkeet, esim. Telapreviiri
- Muita lääkkeitä, joilla tiedetään olevan yhteisvaikutuksia TORVASTin kanssa, ovat etsetimibi (joka alentaa kolesterolia), varfariini (vähentää verihyytymien muodostumista), suun kautta otettavat ehkäisyvalmisteet, stiripentoli (epilepsialääke), simetidiini (käytetään vatsakipuun ja mahahaavaan), fenatsoni (kipulääke) , kolkisiini (kihdin hoitoon), antasidit (alumiinia ja magnesiumia sisältävät ruoansulatushäiriöt) ja bosepreviiri (käytetään maksasairauksien, kuten hepatiitti C: n hoitoon)
- Lääkkeet, joita ei määrätä lääkärin määräyksestä: mäkikuisma.
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt muita lääkkeitä, myös lääkkeitä, joita lääkäri ei ole määrännyt.
TORVAST ruuan ja juoman kanssa
Katso kohdasta 3 ohjeet TORVASTin ottamiseen. Huomaa seuraavat asiat:
Greippimehu
Älä juo enempää kuin yksi tai kaksi pientä lasillista greippimehua päivässä, koska suuret greippimehun määrät voivat muuttaa TORVASTin vaikutuksia.
Alkoholi
Vältä liiallista alkoholin käyttöä tämän lääkkeen käytön aikana. Katso lisätietoja kohdasta 2 "Varoitukset ja varotoimet".
Varoitukset On tärkeää tietää, että:
Raskaus ja imetys
Älä käytä TORVASTia, jos olet raskaana tai suunnittelet raskautta.
Älä käytä TORVASTia, jos epäilet olevasi raskaana, ellet käytä tehokasta ehkäisymenetelmää.
Älä käytä TORVASTia, jos imetät.
TORVASTin turvallisuutta raskauden ja imetyksen aikana ei ole vielä osoitettu.
Kysy lääkäriltäsi tai apteekista neuvoa ennen minkään lääkkeen käyttöä.
Ajaminen ja koneiden käyttö
Yleensä tämä lääke ei vaikuta ajokykyyn tai koneiden käyttökykyyn. Älä kuitenkaan aja, jos tämä lääke vaikuttaa ajokykyysi. Älä käytä työkaluja tai koneita, jos tämä lääke heikentää kykyäsi käyttää niitä.
Tärkeää tietoa TORVAST -valmisteen sisältämistä aineista
Jos lääkäri on kertonut sinulle, että sinulla on "intoleranssi tietyille sokerityypeille, ota yhteys lääkäriisi ennen tämän lääkevalmisteen ottamista.
Annos, antotapa ja antotapa Torvastin käyttö: Annostus
Ennen hoidon aloittamista lääkäri määrää matalan kolesterolin ruokavalion ja sinun on myös noudatettava ruokavaliota TORVAST -hoidon aikana.
TORVASTin tavanomainen aloitusannos on 10 mg kerran vuorokaudessa aikuisilla ja 10 -vuotiailla ja sitä vanhemmilla lapsilla. Tarvittaessa lääkäri voi suurentaa tätä annosta, kunnes tarvittava annos on saavutettu. Lääkäri muuttaa annostusta vähintään 4 viikon välein. TORVAST -enimmäisannos on 80 mg kerran päivässä aikuisille ja 20 mg kerran päivässä lapsille.
TORVAST -tabletit on nieltävä kokonaisina veden kanssa, ja ne voidaan ottaa mihin aikaan päivästä tahansa, ruoan kanssa tai ilman. Yritä kuitenkin ottaa tabletit samaan aikaan joka päivä.
Ota tätä lääkettä juuri sen verran kuin lääkäri on määrännyt. Jos olet epävarma, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Lääkäri määrää TORVAST -hoidon keston.
Jos sinusta tuntuu, että TORVASTin vaikutus on liian voimakas tai liian heikko, ota yhteys lääkäriisi.
Yliannostus Mitä tehdä, jos olet ottanut liian suuren Torvast -valmisteen?
Jos otat enemmän TORVASTia kuin sinun pitäisi
Jos otat vahingossa liikaa TORVAST -tabletteja (enemmän kuin tavallinen vuorokausiannos), ota yhteys lääkäriisi tai lähimpään sairaalaan.
Jos unohdat ottaa TORVASTin
Jos unohdat ottaa annoksen, ota seuraava annos oikeaan aikaan.
Älä ota kaksinkertaista annosta korvataksesi unohtamasi tabletin.
Jos lopetat TORVASTin käytön
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Sivuvaikutukset Mitkä ovat Torvastin sivuvaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Jos sinulla ilmenee jokin seuraavista vakavista haittavaikutuksista, lopeta tablettien käyttö ja kerro siitä heti lääkärille tai mene lähimmän sairaalan ensiapuun.
Harvinaiset: voi esiintyä enintään 1 käyttäjällä 1000: sta:
- Vakava allerginen reaktio, joka aiheuttaa kasvojen, kielen ja kurkun turpoamista ja voi aiheuttaa suuria hengitysvaikeuksia.
- Vakava tila, johon liittyy ihon kuorimista ja turvotusta, ihon, suun, silmien, sukupuolielinten rakkuloita ja kuumetta. Ihottuma, johon liittyy punertavia laikkuja erityisesti kämmenissä tai jalkapohjissa, mikä voi aiheuttaa rakkuloita
- Jos sinulla on lihasheikkoutta, -kipua tai -kipua ja etenkin jos tunnet huonovointisuutta ja sinulla on korkea kuume samanaikaisesti, tämä voi johtua epänormaalista lihasten hajoamisesta. Epänormaali lihasten hajoaminen ei aina häviä, vaikka lopetat atorvastatiinin käytön: se voi olla hengenvaarallista ja johtaa munuaisongelmiin.
Hyvin harvinainen: voi esiintyä enintään 1 käyttäjällä 10000: sta:
- Jos sinulle ilmaantuu odottamatonta tai epätavallista verenvuotoa tai mustelmia, tämä voi viitata maksan toimintahäiriöön.Sinun pitäisi nähdä lääkäri mahdollisimman pian.
Muut haittavaikutukset, joita TORVASTilla voi esiintyä
Yleisiä haittavaikutuksia (voi esiintyä enintään 1 käyttäjällä 10: stä) ovat:
- Nenän tulehdus, kurkkukipu, nenäverenvuoto
- Allergiset reaktiot
- Verensokeriarvojen nousu (jos sinulla on diabetes, sinun on jatkettava verensokeritasosi tarkkaa seurantaa), veren kreatiniinikinaasin nousu
- Päänsärky
- Pahoinvointi, ummetus, ilmavaivat, ruoansulatushäiriöt, ripuli
- Nivelkipu, lihaskipu ja selkäkipu,
- Poikkeavat laboratoriokokeet maksan toiminnalle
Melko harvinaisia haittavaikutuksia (voi esiintyä enintään 1 käyttäjällä 100: sta) ovat:
- Anoreksia (ruokahaluttomuus), painonnousu, verensokerin lasku (jos sinulla on diabetes, sinun on jatkettava verensokerisi tarkkaa seurantaa)
- Painajaisia, unettomuutta
- Huimaus, vähentynyt tunne tai pistely sormissa ja varpaissa, heikentynyt kipu- tai kosketusherkkyys, makuhäiriö, muistin menetys
- Näön hämärtyminen
- Korvien ja / tai pään soiminen
- Oksentelu, röyhtäily, ylä- ja alavatsakipu, haimatulehdus (haimatulehdus ja vatsakipu)
- Hepatiitti (maksatulehdus)
- Ihottuma, ihottuma ja kutina, nokkosihottuma, hiustenlähtö
- Niskakipu, lihasten väsymys
- Väsymys, huonovointisuus, heikkous, rintakipu, turvotus erityisesti nilkoissa (turvotus), kohonnut kehon lämpötila
- virtsatesti positiivinen valkosolujen suhteen
Harvinaisia haittavaikutuksia (voi esiintyä enintään 1 käyttäjällä 1000: sta) ovat:
- näköhäiriöt
- odottamaton verenvuoto tai hematooma
- keltaisuus (ihon ja silmänvalkuaisten keltaisuus)
- jänteiden vaurioituminen
Hyvin harvinaisia haittavaikutuksia (voi esiintyä enintään 1 käyttäjällä 10000: sta) ovat:
- allerginen reaktio
- oireita voivat olla äkillinen hengityksen vinkuminen ja rintakipu tai puristava tunne rinnassa, silmäluomien, kasvojen, huulten, suun, kielen tai kurkun turpoaminen, hengitysvaikeudet, romahtaminen
- kuulon menetys
- gynekomastia (rintojen suureneminen miehillä ja naisilla).
Mahdolliset haittavaikutukset, joita on raportoitu joidenkin statiinien (samantyyppisten lääkkeiden) yhteydessä:
- seksuaalisia vaikeuksia
- masennus
- hengitysvaikeudet, mukaan lukien jatkuva yskä ja / tai hengityksen vinkuminen tai kuume
- diabetes. Se on todennäköisempää, jos sinulla on korkea verensokeri- ja rasvapitoisuus, olet ylipainoinen ja sinulla on korkea verenpaine.Lääkärisi seuraa sinua tämän lääkkeen käytön aikana.
Sivuvaikutusten ilmoittaminen
Jos havaitset haittavaikutuksia, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä koskee myös kaikkia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan kansallisen ilmoitusjärjestelmän kautta. .Agenziafarmaco.gov.it / it / vastuullinen.
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkkeen turvallisuudesta.
Vanhentuminen ja säilyttäminen
Ei lasten ulottuville eikä näkyville. Tämä lääke ei vaadi erityisiä säilytysolosuhteita.
Älä käytä tätä lääkettä etiketissä tai pakkauksessa mainitun viimeisen käyttöpäivämäärän {EXP} jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Älä heitä lääkkeitä viemäriin tai talousjätteisiin. Kysy apteekista, kuinka heittää pois lääkkeet, joita et enää käytä. Tämä auttaa suojelemaan ympäristöä.
Koostumus ja lääkemuoto
Mitä TORVAST sisältää
TORVASTin vaikuttava aine on atorvastatiini.
Yksi kalvopäällysteinen tabletti sisältää 10 mg atorvastatiinia (atorvastatiinikalsiumtrihydraattina)
Yksi kalvopäällysteinen tabletti sisältää 20 mg atorvastatiinia (atorvastatiinikalsiumtrihydraattina)
Yksi kalvopäällysteinen tabletti sisältää 40 mg atorvastatiinia (atorvastatiinikalsiumtrihydraattina)
Yksi kalvopäällysteinen tabletti sisältää 80 mg atorvastatiinia (atorvastatiinikalsiumtrihydraattina)
Muut TORVASTin aineosat ovat: kalsiumkarbonaatti (E170), mikrokiteinen selluloosa (E460), laktoosimonohydraatti, kroskarmelloosinatrium, polysorbaatti 80 (E433), hyproloosi (E463) ja magnesiumstearaatti (E572).
TORVAST -tablettipäällyste sisältää hypromelloosia (E464), makrogolia 8000, titaanidioksidia (E171), talkkia (E553b), simetikonia, emulgointiaine stearaatteja, sakeutusaineita (metyyliselluloosa, ksantaanikumi), bentsoehappoa ja sorbiinihappoa
TORVAST -valmisteen kuvaus ja pakkaus
TORVAST 10 mg kalvopäällysteiset tabletit ovat valkoisia ja pyöreitä. Niiden toisella puolella on merkintä "10" ja toisella puolella "ATV".
TORVAST 20 mg kalvopäällysteiset tabletit ovat valkoisia ja pyöreitä. Niiden toisella puolella on merkintä "20" ja toisella puolella "ATV".
TORVAST 40 mg kalvopäällysteiset tabletit ovat valkoisia ja pyöreitä. Niiden toisella puolella on merkintä "40" ja toisella puolella "ATV".
TORVAST 80 mg kalvopäällysteiset tabletit ovat valkoisia ja pyöreitä. Niiden toisella puolella on merkintä "80" ja toisella puolella "ATV".
Läpipainopakkaukset, jotka koostuvat polyamidi / alumiini- ja polyvinyylikloridilevystä ja alumiinitiivistelevystä, jossa on vinyyli-kuumasaumauslakka.
HDPE-pullo sisältää kuivausainetta ja siinä on lapsiturvallinen suljin, jossa on puristettava ja kierrettävä korkki
TORVAST-tabletteja on saatavana 4, 7, 10, 14, 20, 28, 30, 50, 56, 84, 90, 98 ja 100 kalvopäällysteisen tabletin läpipainopakkauksissa ja 50, 84, 100, 200 (sairaalapakkauksissa) 10 kalvopäällysteistä tablettia ja 500 kalvopäällysteistä tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Alkuperäinen pakkausseloste: AIFA (Italian lääkevirasto). Sisältö julkaistu tammikuussa 2016. Esitetyt tiedot eivät välttämättä ole ajan tasalla.
Jotta saat käyttöösi uusimman version, on suositeltavaa käyttää AIFA: n (Italian Medicines Agency) verkkosivustoa. Vastuuvapauslauseke ja hyödyllistä tietoa.
01.0 LÄÄKEVALMISTEEN NIMI
TORVAST -TABLETIT, PÄÄLLYTTYNYT KALVOLLA
02.0 LAADULLINEN JA MÄÄRÄLLINEN KOOSTUMUS
Yksi tabletti sisältää 10 mg atorvastatiinia (atorvastatiinikalsiumtrihydraattina).
Apuaineet:
Yksi TORVAST 10 mg tabletti sisältää 27,25 mg laktoosimonohydraattia.
Yksi tabletti sisältää 20 mg atorvastatiinia (atorvastatiinikalsiumtrihydraattina).
Apuaineet:
Yksi TORVAST 20 mg tabletti sisältää 54,50 mg laktoosimonohydraattia.
Yksi tabletti sisältää 40 mg atorvastatiinia (atorvastatiinikalsiumtrihydraattina).
Apuaineet:
Yksi TORVAST 40 mg tabletti sisältää 109,00 mg laktoosimonohydraattia.
Yksi tabletti sisältää 80 mg atorvastatiinia (atorvastatiinikalsiumtrihydraattina).
Apuaineet:
Yksi TORVAST 80 mg tabletti sisältää 218,00 mg laktoosimonohydraattia.
Täydellinen apuaineluettelo, katso kohta 6.1.
03.0 LÄÄKEMUOTO
Kalvopäällysteiset tabletit.
Pyöreät valkoiset kalvopäällysteiset tabletit, joissa on toisella puolella merkintä "10" ja toisella puolella "ATV".
Valkoiset, pyöreät kalvopäällysteiset tabletit, joissa on toisella puolella merkintä "20" ja toisella puolella "ATV".
Pyöreät valkoiset kalvopäällysteiset tabletit, joissa on toisella puolella merkintä "40" ja toisella puolella "ATV".
Valkoiset, pyöreät kalvopäällysteiset tabletit, joissa on toisella puolella merkintä "80" ja toisella puolella "ATV".
04.0 KLIINISET TIEDOT
04.1 Käyttöaiheet
Hyperkolesterolemia
TORVAST on tarkoitettu ruokavalion täydentämiseksi kokonaiskolesterolin, LDL -kolesterolin, apolipoproteiini B- ja triglyseridipitoisuuksien alentamiseksi aikuisilla, nuorilla ja 10 -vuotiailla tai sitä vanhemmilla lapsilla, joilla on primaarinen hyperkolesterolemia, mukaan lukien perinnöllinen hyperkolesterolemia (heterotsygoottinen variantti) tai sekahyperlipemia (vastaa Fredricksonin luokituksen tyypit IIa ja IIb), kun ruokavalio ja muut ei-farmakologiset toimenpiteet ovat riittämättömiä.
TORVAST on myös tarkoitettu alentamaan kokonaiskolesterolia ja LDL-kolesterolia aikuisilla, joilla on homotsygoottinen perinnöllinen hyperkolesterolemia, täydentäen muita lipidejä alentavia hoitoja (esim. LDL-afereesi) tai jos tällaisia hoitoja ei ole saatavilla.
Sydän- ja verisuonitautien ehkäisy
Sydän- ja verisuonitapahtumien ehkäisy aikuispotilailla, joilla on suuri riski ensimmäiselle sydän- ja verisuonitapahtumalle (ks. Kohta 5.1), täydentäen muiden riskitekijöiden korjaamista.
04.2 Annostus ja antotapa
Annostus
Potilaalle on asetettava tavanomainen kolesterolia alentava vähärasvainen ruokavalio ennen TORVAST-hoidon aloittamista, ja hänen on jatkettava ruokavaliotaan TORVAST-hoidon aikana.
Annostus on yksilöitävä ottaen huomioon lähtötilanteen LDL -kolesterolitasot, hoidon tavoite ja potilaan vaste.
Tavanomainen aloitusannos on 10 mg kerran vuorokaudessa. Annosta on muutettava vähintään 4 viikon välein. Suurin annos on 80 mg kerran vuorokaudessa.
Primaarinen hyperkolesterolemia ja sekamuotoinen hyperlipemia
Suurin osa potilaista saatiin hallintaan TORVAST 10 mg: lla kerran vuorokaudessa. Terapeuttinen vaste ilmenee kahden viikon kuluessa ja suurin terapeuttinen vaste saavutetaan yleensä 4 viikon kuluessa. Kroonisen hoidon aikana vaste säilyy.
Heterotsygoottinen perheperäinen hyperkolesterolemia
Potilaiden on aloitettava TORVAST 10 mg: n vuorokausiannos. Annostus on yksilöitävä ja sitä on säädettävä 4 viikon välein enintään 40 mg: aan vuorokaudessa. Sen jälkeen annos voidaan nostaa enintään 80 mg: aan vuorokaudessa tai sappihappoa sitova aine voidaan yhdistää 40 mg: aan atorvastatiinia kerran vuorokaudessa.
Homotsygoottinen perheperäinen hyperkolesterolemia
Tietoa on vain vähän (ks. Kohta 5.1).
Atorvastatiinin annos on homotsygoottista perinnöllistä hyperkolesterolemiaa sairastavilla potilailla 10-80 mg / vrk (ks. Kohta 5.1). Näillä potilailla atorvastatiinia tulee käyttää muiden lipidipitoisuutta alentavien hoitojen (esim. LDL-afereesi) lisänä tai jos tällaisia hoitoja ei ole saatavilla.
Sydän- ja verisuonitautien ehkäisy
Ensisijaisissa ehkäisytutkimuksissa käytettiin annosta 10 mg / vrk. Nykyisten ohjeiden edellyttämien kolesterolitasojen (LDL) saavuttamiseksi voidaan tarvita suurempia annoksia.
Annostus potilailla, joilla on munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa (ks. Kohta 4.4).
Annostus potilailla, joilla on maksan vajaatoiminta
TORVASTia tulee käyttää varoen potilailla, joilla on maksan vajaatoiminta (ks. Kohdat 4.4 ja 5.2). TORVAST on vasta -aiheinen potilaille, joilla on aktiivinen maksasairaus (ks. Kohta 4.3).
Käyttö vanhuksilla
Teho ja siedettävyys suositelluilla annoksilla hoidetuilla yli 70 -vuotiailla potilailla ovat samanlaiset kuin yleisväestössä.
Pediatrinen käyttö
Hyperkolesterolemia:
Lasten käyttöön saavat ryhtyä vain lasten hyperlipidemian hoitoon perehtyneet lääkärit, ja potilaat on arvioitava uudelleen säännöllisesti edistymisen arvioimiseksi.
10 -vuotiaille ja sitä vanhemmille potilaille atorvastatiinin suositeltu aloitusannos on 10 mg vuorokaudessa ja titraus enintään 20 mg vuorokaudessa. Titraus on tehtävä lapsipotilaiden yksilöllisen vasteen ja siedettävyyden perusteella. Turvallisuustiedot lapsipotilaille, joita hoidetaan yli 20 mg: n annoksilla, jotka vastaavat noin 0,5 mg / kg, ovat rajalliset.
Kokemusta 6-10-vuotiaista lapsista on rajallisesti (ks. Kohta 5.1) Atorvastatiinia ei ole tarkoitettu alle 10-vuotiaiden potilaiden hoitoon.
Muut lääkemuodot / vahvuudet voivat olla sopivampia tälle potilasryhmälle.
Antotapa
TORVAST on tarkoitettu suun kautta. Jokainen päivittäinen annos annetaan yhtenä annoksena ja se voidaan antaa milloin tahansa päivästä riippumatta aterioista.
04.3 Vasta -aiheet
TORVAST on vasta -aiheinen seuraavissa tapauksissa:
- Yliherkkyys vaikuttavalle aineelle tai lääkkeen apuaineille
- Aktiivinen maksasairaus tai selittämätön jatkuva transaminaasiarvojen nousu, yli 3 kertaa normaalin yläraja
- Raskaus, imetys ja hedelmällisessä iässä olevat naiset, jotka eivät käytä asianmukaisia ehkäisymenetelmiä (ks. Kohta 4.6).
04.4 Varoitukset ja käyttöön liittyvät varotoimet
Vaikutukset maksaan
Maksan toimintakokeet on suoritettava ennen hoidon aloittamista ja määräajoin sen jälkeen. Potilaille, joilla ilmenee maksavaurioon viittaavia merkkejä tai oireita, tulee tehdä maksan toimintakokeita. Potilaita, joille kehittyy kohonneita transaminaasiarvoja, on seurattava, kunnes arvot normalisoituvat jos transaminaasiarvot ylittävät yli kolme kertaa ULN -arvon, annoksen pienentämistä tai TORVAST -hoidon lopettamista suositellaan (ks. kohta 4.8).
TORVASTia tulee käyttää varoen potilailla, jotka käyttävät suuria määriä alkoholia ja / tai joilla on ollut maksasairaus.
Aivohalvauksen ehkäisy aggressiivisella kolesterolipitoisuuden alentamisella (SPARCL -tutkimus)
Aivohalvauksen alatyyppien post-hoc -analyysi potilailla, joilla ei ollut iskeemistä kardiomyopatiaa (CHD) ja joilla oli ollut aivohalvaus tai äskettäin ohimenevä iskeeminen hyökkäys (TIA), havaitsi verenvuotohäiriön ilmaantuvuuden korkeamman potilailla, jotka aloittivat atorvastatiinihoidon 80 mg: lla. lumeryhmä. Lisääntynyt riski havaittiin erityisesti potilailla, joilla oli aiempi verenvuotohäiriö tai lakunaarinen infarkti tutkimukseen ilmoittautumisen yhteydessä. Potilailla, joilla on aiemmin ollut verenvuotohäiriö tai lacunar -infarkti, atorvastatiinin 80 mg: n käytön hyöty -riskisuhde on epävarma ja mahdollinen verenvuotohäiriö on harkittava huolellisesti ennen hoidon aloittamista (ks. Kohta 5.1).
Vaikutukset luustolihaksiin
Atorvastatiini, kuten muutkin HMG-CoA-reduktaasin estäjät, voi harvoin vaikuttaa luustolihaksiin ja aiheuttaa myalgiaa, myosiittia ja myopatiaa, jotka voivat edetä rabdomyolyysiin, mahdollisesti kuolemaan johtavaan tilaan, jolle on tunnusomaista kreatiinifosfokinaasin (CPK) lisääntyminen. (> 10 kertaa ULN), myoglobinemia ja myoglobinuria, jotka voivat johtaa munuaisten vajaatoimintaan.
Ennen hoitoa
Atorvastatiinia tulee määrätä varoen potilaille, joilla on rabdomyolyysille alttiita tekijöitä.Kreatiinifosfokinaasipitoisuus (CPK) on mitattava ennen hoidon aloittamista seuraavissa kliinisissä olosuhteissa:
- Munuaisten vajaatoiminta
- Kilpirauhasen vajaatoiminta
- Perinnöllisten lihassairauksien henkilökohtainen tai sukututkimus
- Aiempi statiinien tai fibraattien käyttöön liittyvä lihastoksisuus
- Aikaisempi maksasairaus ja / tai kun suuria määriä alkoholijuomia kulutetaan
- Iäkkäillä (yli 70 -vuotiailla) näiden mittausten tarve on arvioitava muiden rabdomyolyysia altistavien tekijöiden perusteella.
- Tilanteet, joissa plasman pitoisuudet lisääntyvät, kuten yhteisvaikutukset (ks. Kohta 4.5) ja tietyissä potilasryhmissä, mukaan lukien geneettiset alaryhmät (ks. Kohta 5.2)
Tällaisissa tilanteissa hoidon riskiä on punnittava mahdollisen hyödyn kanssa ja kliinistä seurantaa suositellaan.
Jos CPK -taso on kohonnut merkittävästi lähtötasosta (> 5 kertaa ULN), hoitoa ei saa aloittaa.
Kreatiinifosfokinaasin mittaus
Kreatiinifosfokinaasia (CPK) ei pidä mitata rasittavan harjoittelun jälkeen tai mahdollisen lisääntyneen CPK -syyn vuoksi, koska tämä vaikeuttaa tulkittavan arvon tulkintaa. ), CPK-tasot on mitattava uudelleen seuraavan 5-7 päivän kuluessa tulosten vahvistamiseksi.
Hoidon aikana
- Potilaita on neuvottava ilmoittamaan viipymättä lihaskipuista, -kouristuksista tai -heikkoudesta, erityisesti jos niihin liittyy huonovointisuutta tai kuumetta.
- Jos näitä oireita ilmenee, kun potilasta hoidetaan atorvastatiinilla, hänen CPK -tasonsa on mitattava. Jos nämä tasot nousevat merkittävästi (> 5 kertaa ULN), hoito on lopetettava.
- Jos lihasoireet ovat vakavia ja aiheuttavat päivittäistä epämukavuutta, vaikka CPK -taso olisi ≤ 5 kertaa ULN, hoidon lopettamista on harkittava.
- Jos oireet häviävät ja CPK -tasot normalisoituvat, voidaan harkita atorvastatiinin tai muun statiinin aloittamista uudelleen pienemmällä annoksella ja huolellista seurantaa.
- Atorvastatiinihoito on lopetettava, jos CPK -tasot nousevat kliinisesti merkittävästi (> 10 x ULN) tai jos diagnosoidaan tai epäillään rabdomyolyysiä.
Samanaikainen hoito muiden lääkevalmisteiden kanssa
Rabdomyolyysin riski kasvaa, kun atorvastatiinia annetaan samanaikaisesti tiettyjen lääkevalmisteiden kanssa, jotka voivat lisätä atorvastatiinin pitoisuutta plasmassa, kuten voimakkaat CYP3A4: n estäjät tai kuljetusproteiinit (esim. Syklosporiini, telitromysiini, klaritromysiini, delavirdiini, stiripentoli, ketokonatsoli, vorikonatsoli, itrakonatsoli, itrakonatsoli) ) ja HIV -proteaasin estäjät, mukaan lukien ritonaviiri, lopinaviiri, atatsanaviiri, indinaviiri, darunaviiri jne.) Myopatian riski voi myös lisääntyä, kun gemfibrotsiilia ja muita fibriinihappojohdannaisia, erytromysiiniä, niasiinia ja etsetimibiä käytetään samanaikaisesti. vaihtoehtoisia (ei-vuorovaikutteisia) hoitoja.
Jos näiden lääkevalmisteiden ja atorvastatiinin samanaikainen käyttö on välttämätöntä, hoidon riskit ja hyödyt on punnittava huolellisesti. Kun potilaat käyttävät lääkkeitä, jotka nostavat atorvastatiinin pitoisuutta plasmassa, suositellaan pienempää atorvastatiinin aloitusannosta. Lisäksi, jos samanaikaista hoitoa annetaan voimakkailla CYP3A4: n estäjillä, on harkittava suurempaa atorvastatiinin aloitusannosta ja asianmukaista kliinistä seurantaa. näistä potilaista suositellaan (ks. kohta 4.5).
Atorvastatiinin ja fusidiinihapon samanaikaista käyttöä ei suositella, ja siksi voidaan harkita atorvastatiinin väliaikaista lopettamista fusidiinihappohoidon aikana (ks. Kohta 4.5).
Pediatrinen käyttö
Pediatristen potilaiden kehitysturvallisuutta ei ole varmistettu (ks. Kohta 4.8).
Interstitiaalinen keuhkosairaus
Joidenkin statiinien, erityisesti pitkäaikaishoidon, yhteydessä on raportoitu poikkeuksellisia interstitiaalisia keuhkosairauksia (ks. Kohta 4.8). Esittäviä ominaisuuksia voivat olla hengenahdistus, ei-tuottava yskä ja huonontunut terveys (väsymys, laihtuminen ja kuume). Jos potilaan epäillään kehittyvän interstitiaalinen keuhkosairaus, statiinihoito on lopetettava.
Diabetes mellitus
Jotkut todisteet viittaavat siihen, että statiinit lisäävät verensokeria luokkavaikutuksena ja joillakin potilailla, joilla on suuri riski sairastua diabetekseen, voivat aiheuttaa sellaista hyperglykemiaa, että diabeteslääkitys on tarkoituksenmukaista. Tämä riski on kuitenkin suurempi kuin verisuonten riskin pieneneminen statiineja käytettäessä, joten sen ei pitäisi olla syy hoidon lopettamiseen.
Riskiryhmään kuuluvia potilaita (paastoglukoosi 5,6 - 6,9 mmol / l, BMI> 30 kg / m ≥, kohonneet triglyseridit, kohonnut verenpaine) on seurattava sekä kliinisesti että biokemiallisesti kansallisten ohjeiden mukaisesti.
Apuaineet
TORVAST sisältää laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, Lapp-laktaasin puutos tai glukoosi-galaktoosi-imeytymishäiriö, ei tule käyttää tätä lääkettä.
04.5 Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset
Muiden lääkevalmisteiden vaikutukset atorvastatiiniin
Atorvastatiini metaboloituu sytokromi P450 3A4: n (CYP3A4) välityksellä ja se on kuljetusproteiinien eli maksan kuljettajan OATP1B1 substraatti. Lisää myopatian riskiä. Riski voi kasvaa myös, jos samanaikaisesti annetaan diatorvastatiinia muiden lääkkeiden kanssa, jotka voivat aiheuttaa myopatiaa, kuten fibriinihappojohdannaisia ja etsetimibiä (ks. kohta 4.4).
CYP3A4: n estäjät
Voimakkaiden CYP3A4 -estäjien on osoitettu lisäävän merkittävästi atorvastatiinipitoisuuksia (ks. Taulukko 1 ja tarkemmat tiedot alla). Voimakkaiden CYP3A4 -estäjien (esim. Syklosporiini, telitromysiini, klaritromysiini, delavirdiini, stiripentoli, ketokonatsoli, vorikonatsoli, itrakonatsoli, posakonatsoli ja HIV -proteaasi -inhibiittorit, mukaan lukien ritonaviiri, lopinoviiri, atatsanaviiri jne.) Samanaikaista käyttöä on vältettävä. -näiden lääkevalmisteiden samanaikaista käyttöä atorvastatiinin kanssa ei voida välttää, pienempiä aloitus- ja enimmäisannoksia on harkittava ja näiden potilaiden kliinistä seurantaa suositellaan (ks. taulukko 1).
Kohtalaiset CYP3A4: n estäjät (esim. Erytromysiini, diltiatseemi, verapamiili ja flukonatsoli) voivat lisätä atorvastatiinin pitoisuutta plasmassa (ks. Taulukko 1). Lisääntynyttä myopatian riskiä on havaittu käytettäessä erytromysiiniä yhdessä statiinien kanssa Yhteisvaikutustutkimuksia, joissa arvioidaan amiodaronin tai verapamiilin vaikutuksia atorvastatiiniin, ei ole tehty.
Sekä amiodaronin että verapamiilin tiedetään estävän CYP34A: ta, ja samanaikainen anto atorvastatiinin kanssa saattaa suurentaa atorvastatiinialtistusta. Siksi pienintä enimmäisannosta on harkittava ja potilaan kliinistä seurantaa suositellaan. Kun kohtalaisia CYP3A4-estäjiä käytetään samanaikaisesti. seurantaa suositellaan hoidon aloittamisen jälkeen tai estäjän annoksen muuttamisen jälkeen.
CYP3A4 -induktorit
Atorvastatiinin ja sytokromi P450 3A: n indusoijien (esim. Efavirentsi, rifampisiini, mäkikuisma) samanaikainen anto voi johtaa vaihteleviin plasman atorvastatiinipitoisuuksien laskuihin. Rifampisiinin kahden vuorovaikutusmekanismin (sytokromi P450 3A: n induktio ja kuljettaja OATP1B1: n esto hepatosyyttitasolla) vuoksi atorvastatiinin ja rifampisiinin samanaikaista käyttöä suositellaan, koska rifampisiinin antamisen jälkeen on viivästynyt atorvastatiinin anto. Rifampisiinin vaikutus atorvastatiinin pitoisuuksiin maksasoluissa on kuitenkin tuntematon, ja jos samanaikaista käyttöä ei voida välttää, potilaiden tehoa on seurattava huolellisesti.
Kuljetusproteiinin estäjät
Kuljetusproteiinin estäjät (esim. suositellaan tehon kliinistä seurantaa (ks. taulukko 1).
Gemfibrotsiili / fibriinihappojohdannaiset
Pelkästään fibraattien käyttöön liittyy toisinaan lihakseen liittyviä tapahtumia, mukaan lukien rabdomyolyysi. Jos samanaikaista käyttöä ei voida välttää, on käytettävä pienintä atorvastatiiniannosta saavuttaakseen terapeuttisen vaikutuksen ja potilaita on seurattava riittävästi (ks. Kohta 4.4).
Etsetimibi
Pelkän etsetimibin käyttö liittyy lihakseen liittyviin tapahtumiin, mukaan lukien rabdomyolyysi. Näiden tapahtumien riski voi kasvaa, kun etsetimibiä ja atorvastatiinia annetaan samanaikaisesti. Näille potilaille suositellaan asianmukaista kliinistä seurantaa.
Colestipol
Atorvastatiinin ja sen aktiivisten metaboliittien pitoisuudet plasmassa pienenivät (noin 25%), kun kolestipolia annettiin samanaikaisesti TORVASTin kanssa. Vaikutukset lipideihin olivat kuitenkin suurempia, kun TORVASTia ja kolestipolia annettiin samanaikaisesti kuin yksinään.
Fusidiinihappo
Yhteisvaikutustutkimuksia atorvastatiinin ja fusidiinihapon välillä ei ole tehty. Kuten muidenkin statiinien kohdalla, lihakseen liittyviä tapahtumia, mukaan lukien rabdomyolyysi, on raportoitu tämän yhdistyksen kanssa markkinoille tulon jälkeen. Tämän vuorovaikutuksen mekanismia ei tunneta. Potilaita on seurattava tarkasti ja atorvastatiinihoidon keskeyttäminen tilapäisesti saattaa olla asianmukaista.
Atorvastatiinin vaikutukset muihin lääkevalmisteisiin
Digoksiini
Toistuvien digoksiiniannosten ja 10 mg atorvastatiinin samanaikainen käyttö muutti hieman digoksiinipitoisuuksia plasmassa. Digoksiinia käyttäviä potilaita on seurattava asianmukaisesti.
Ehkäisypillerit
TORVASTin ja suun kautta otettavan ehkäisyvalmisteen samanaikainen käyttö nosti noretindronin ja etinyyliestradiolin pitoisuuksia plasmassa.
Varfariini
Kroonista varfariinihoitoa saavilla potilailla tehdyssä kliinisessä tutkimuksessa atorvastatiinin 80 mg: n samanaikainen anto aiheutti protrombiiniajan pienen pienen, noin 1,7 sekunnin pienenemisen ensimmäisten 4 annospäivän aikana, mikä palautui normaaliksi 15 päivän kuluessa atorvastatiinihoidosta . Vaikka kliinisesti merkittäviä antikoagulanttiinteraktioita on raportoitu vain hyvin harvoissa tapauksissa, protrombiiniaika on määritettävä ennen atorvastatiinihoidon aloittamista potilailla, jotka käyttävät kumariiniantikoagulantteja, ja tarpeeksi usein hoidon aikana, jotta protrombiiniaika ei muutu merkittävästi. Kun vakaa protrombiiniaika on dokumentoitu, protrombiiniaikoja voidaan seurata välein, joita yleensä suositellaan potilaille, jotka käyttävät kumariiniantikoagulantteja. Jos atorvastatiiniannoksia muutetaan tai ne lopetetaan, sama toimenpide on toistettava. Atorvastatiinihoitoon ei ole liittynyt verenvuotoa tai muita muutoksia protrombiiniajassa potilailla, jotka eivät saa antikoagulantteja.
Pediatriset potilaat
Yhteisvaikutustutkimuksia muiden lääkevalmisteiden kanssa on tehty vain aikuisilla. Yhteisvaikutusten laajuutta pediatrisessa populaatiossa ei tiedetä, Edellä kuvatut aikuisten yhteisvaikutukset ja kohdassa 4.4 luetellut varoitukset on otettava huomioon pediatrisilla potilailla.
Taulukko 1: Samanaikaisesti annettujen lääkkeiden vaikutukset atorvastatiinin farmakokinetiikkaan
& Tiedot muutoksista x-kertaisesti edustavat yksinkertaista osuutta samanaikaisen annon ja pelkän atorvastatiinin välillä (esim. 1 kerta = ei muutosta). Muutostiedot prosentteina edustavat prosentuaalista eroa pelkästään atorvastatiiniin verrattuna (esim. 0% = ei muutosta).
# Katso kliiniset todisteet kohdista 4.4 ja 4.5.
* sisältää yhden tai useamman komponentin, jotka estävät CYP3A4: ää ja voivat lisätä CYP3A4: n kautta metaboloituvan lääkevalmisteen pitoisuuksia plasmassa. 240 ml: n lasillisen greippimehun nauttiminen pienensi aktiivisen ortohydroksidimetaboliitin AUC -arvoja 20,4%. Suuret määrät greippimehua (yli 1,2 l päivässä 5 päivän ajan) lisäsivät greippimehun määrää. Atorvastatiinin AUC 2,5 kertaa ja aktiivinen AUC (atorvastatiini ja metaboliitit).
^ koko atorvastatiinin vastaava aktiivisuus
Lisäys on merkitty "↑", vähennys "↑"
OD = kerran päivässä; SD = kerta -annos; BID = kahdesti päivässä; QID = neljä kertaa päivässä
Taulukko 2: Atorvastatiinin vaikutukset samanaikaisesti annettujen lääkevalmisteiden farmakokinetiikkaan
& Tietojen prosentuaalinen muutos edustaa prosentuaalista eroa pelkästään atorvastatiiniin verrattuna (esim. 0% = ei muutosta)
* Useiden atorvastatiiniannosten ja fenatsonin samanaikainen anto osoitti vain vähän tai ei lainkaan havaittavaa vaikutusta fenatsonin puhdistumaan
Lisäys on merkitty "↑", vähennys "↑"
OD = kerran päivässä; SD = kerta -annos
04.6 Raskaus ja imetys
Hedelmällisessä iässä olevat potilaat
Hedelmällisessä iässä olevien naisten on käytettävä hoidon aikana asianmukaista ehkäisymenetelmää (ks. Kohta 4.3).
Raskaus
TORVAST on vasta -aiheinen raskauden aikana (ks. Kohta 4.3). Turvallisuutta raskaana oleville naisille ei ole osoitettu. Atorvastatiinilla ei ole tehty kontrolloituja kliinisiä tutkimuksia raskaana oleville naisille. Harvinaisia synnynnäisiä poikkeavuuksia on raportoitu kohdunsisäisen altistuksen jälkeen HMG-CoA-reduktaasin estäjille. Eläinkokeet ovat osoittaneet lisääntymistoksisuutta (ks. Kohta 5.3).
Äitien hoito atorvastatiinilla voi alentaa sikiön mevalonaattitasoja, jotka ovat kolesterolin biosynteesin edeltäjiä. Ateroskleroosi on krooninen prosessi ja yleensä rasvaa vähentävien lääkkeiden lopettamisella raskauden aikana ei ole juurikaan vaikutusta primaariseen hyperkolesterolemiaan liittyvään pitkäaikaiseen riskiin.
Näistä syistä TORVASTia ei tule käyttää raskaana oleville tai raskautta yrittäville tai epäileville raskaana oleville naisille. TORVAST -hoito on keskeytettävä raskauden ajaksi tai kunnes on arvioitu, onko potilas raskaana (ks. Kohta 4.3).
Ruokinta-aika
Ei tiedetä, erittyykö atorvastatiini tai sen metaboliitit äidinmaitoon. Rotilla atorvastatiinin ja sen aktiivisten metaboliittien pitoisuudet plasmassa ovat samanlaiset kuin maidossa (ks. Kohta 5.3). ei saa imettää (ks. kohta 4.3) Atorvastatiini on vasta -aiheinen imetyksen aikana (ks. kohta 4.3).
Hedelmällisyys
Eläinkokeissa atorvastatiinilla ei ollut vaikutusta miesten ja naisten hedelmällisyyteen (ks. Kohta 5.3).
04.7 Vaikutus ajokykyyn ja koneiden käyttökykyyn
TORVASTilla on vähäinen vaikutus ajokykyyn tai koneiden käyttökykyyn.
04.8 Haittavaikutukset
Atorvastatiinia ja lumelääkettä koskevissa kontrolloiduissa kliinisissä tutkimuksissa 16 066 potilaalla (8755 atorvastatiinilla ja 7311 lumelääkkeellä) keskimäärin 53 viikon ajan 5,2% atorvastatiinilla hoidetuista potilaista keskeytti hoidon haittavaikutusten vuoksi verrattuna 4%: iin potilaista lumelääkettä.
Seuraavassa taulukossa esitetään TORVASTin turvallisuusprofiili, joka perustuu kliinisistä tutkimuksista saatuun tietoon ja huomattavaan markkinoille tulon jälkeiseen kokemukseen.
Tapahtumien arvioidut esiintymistiheydet perustuvat seuraavaan käytäntöön: yleinen (≥ 1/100,
Infektiot ja tartunnat:
Yleinen: nenänielun tulehdus
Veren ja imukudoksen häiriöt
Harvinainen: trombosytopenia
Immuunijärjestelmän häiriöt
Yleinen: allergiset reaktiot.
Hyvin harvinainen: anafylaksia
Aineenvaihdunta- ja ravitsemushäiriöt
Yleinen: hyperglykemia.
Melko harvinaiset: hypoglykemia, painonnousu, ruokahaluttomuus
Psyykkiset häiriöt
Melko harvinaiset: painajaiset, unettomuus
Hermosto
Yleinen: päänsärky.
Melko harvinainen: huimaus, parestesia, hypestesia, dysgeusia, muistinmenetys
Harvinainen: perifeerinen neuropatia
Silmät:
Melko harvinainen: näön hämärtyminen
Harvinainen: näköhäiriöt
Kuulo ja tasapainoelin
Melko harvinainen: tinnitus
Hyvin harvinainen: kuulon heikkeneminen
Hengityselimet, rintakehä ja välikarsina
Yleinen: nielun ja kurkunpään kipu, nenäverenvuoto
Ruoansulatuselimistö
Yleiset: ummetus, ilmavaivat, dyspepsia, pahoinvointi, ripuli.
Melko harvinainen: oksentelu, ylä- ja alavatsakipu, röyhtäily, haimatulehdus
Maksa ja sappi
Melko harvinainen: hepatiitti
Harvinainen: kolestaasi
Hyvin harvinainen: maksan vajaatoiminta
Iho ja ihonalainen kudos
Melko harvinainen: nokkosihottuma, ihottuma, kutina, hiustenlähtö.
Harvinainen: angioneuroottinen turvotus, rakkulapurkaukset, mukaan lukien erythema multiforme, Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi
Tuki- ja liikuntaelimistön häiriöt
Yleinen: lihaskipu, nivelkipu, raajakipu, lihaskouristukset, nivelten turvotus, selkäkipu
Melko harvinainen: niskakipu, lihasten väsymys
Harvinainen: myopatia, myosiitti, rabdomyolyysi, tendinopatia, jota joskus monimutkaistaa repeämä
Lisääntymisjärjestelmän ja rintojen sairaudet
Hyvin harvinainen: gynekomastia
Yleisoireet ja antopaikassa todettavat haitat
Melko harvinaiset: huonovointisuus, voimattomuus, rintakipu, perifeerinen turvotus, väsymys, kuume
Diagnostiset testit
Yleinen: epänormaali maksan toimintakoe, kreatiinifosfokinaasin nousu
Melko harvinainen: leukosyyttien positiivinen virtsatesti
Kuten muidenkin HMG-CoA-reduktaasin estäjien kohdalla, TORVAST-hoitoa saaneilla potilailla on raportoitu seerumin transaminaasiarvojen nousua. Nämä muutokset olivat yleensä lieviä ja ohimeneviä eivätkä vaatineet hoidon keskeyttämistä. Kliinisesti merkitsevää (> 3 kertaa ULN) nousua seerumin transaminaasiarvoissa havaittiin 0,8%: lla TORVAST -hoitoa saaneista potilaista. Nämä lisäykset olivat annoksesta riippuvaisia ja palautuvia kaikilla potilailla.
Kreatiinifosfokinaasipitoisuuden (CPK) nousua yli kolme kertaa normaalin ylärajan on havaittu 2,5%: lla TORVAST-hoitoa saaneista potilaista kliinisissä tutkimuksissa, kuten muillakin HMG-CoA-reduktaasin estäjillä. Pitoisuudet, jotka olivat yli 10 kertaa normaalin ylärajan, havaittiin 0,4%: lla TORVAST -hoitoa saaneista potilaista (ks. Kohta 4.4).
Pediatriset potilaat
Kliinisen turvallisuuden tietokanta sisältää turvallisuustietoja 249 atorvastatiinilla hoidetusta lapsipotilaasta, mukaan lukien 7 alle 6-vuotiasta potilasta, 14 6-9-vuotiasta potilasta ja 228 10-17-vuotiasta potilasta.
Hermosto
Yleinen: Päänsärky
Ruoansulatuselimistö
Yleinen: vatsakipu
Diagnostiset testit
Yleinen: Alaniiniaminotransferaasiarvon nousu, seerumin fosfokinaasin nousu
Saatavilla olevien tietojen perusteella haittavaikutusten esiintymistiheyden, tyypin ja vakavuuden lapsilla odotetaan olevan sama kuin aikuisilla. Pitkäaikainen turvallisuuskokemus lapsipotilaista on tällä hetkellä rajallinen.
Seuraavia haittavaikutuksia on raportoitu statiinien käytön yhteydessä:
- Seksuaalinen toimintahäiriö
- Masennus
- Poikkeustapaukset interstitiaaliseen keuhkosairauteen, erityisesti pitkäaikaishoidossa (ks. Kohta 4.4)
- Diabetes mellitus: esiintymistiheys riippuu riskitekijöistä (paastoverensokeri ≥ 5,6 mmol / l, BMI> 30 kg / m≥, kohonneet triglyseriditasot, verenpainetauti).
04.9 Yliannostus
TORVAST -yliannostukseen ei ole saatavilla erityistä hoitoa. Yliannostustapauksessa hoidetaan oireenmukaisesti ja aloitetaan tukitoimenpiteet tarpeen mukaan. Maksan toimintakokeet on suoritettava ja seerumin CPK -tasoja seurattava. Koska atorvastatiini sitoutuu voimakkaasti plasman proteiineihin, hemodialyysin ei odoteta lisäävän merkittävästi atorvastatiinin puhdistumaa.
05.0 FARMAKOLOGISET OMINAISUUDET
05.1 Farmakodynaamiset ominaisuudet
Farmakoterapeuttinen ryhmä: aineet muokkaajat ja lipidejä, HMG-CoA-reduktaasin estäjät, ATC-koodi: C10AA05.
Atorvastatiini on selektiivinen ja kilpaileva HMG-CoA-reduktaasin estäjä. Maksan triglyseridit ja kolesteroli sisällytetään erittäin pienitiheyksisiin lipoproteiineihin (VLDL) ja vapautuvat plasmaan jakautumaan perifeerisiin kudoksiin. Pienitiheyksiset lipoproteiinit (LDL) muodostuvat VLDL: stä, ja ne katabolisoivat pääasiassa suuren affiniteetin LDL-reseptori (LDL-reseptori).
Atorvastatiini alentaa plasman kolesterolia ja seerumin lipoproteiinipitoisuuksia, estäen HMG-CoA-reduktaasia ja siten maksan kolesterolin biosynteesiä ja lisää solun pinnalla olevien maksan LDL-reseptorien määrää, mikä lisää LDL: n imeytymistä ja kataboliaa.
Atorvastatiini vähentää LDL: n tuotantoa ja LDL -hiukkasten lukumäärää Atorvastatiini aiheuttaa silmiinpistävää ja pitkäaikaista LDL -reseptorin aktiivisuuden lisääntymistä yhdessä hyödyllisen muutoksen kanssa kiertävien LDL -hiukkasten laadussa. Atorvastatiini alentaa tehokkaasti LDL-kolesterolia potilailla, joilla on homotsygoottinen perinnöllinen hyperkolesterolemia.
Annos -vaste -tutkimuksessa atorvastatiinin osoitettiin pienentävän kokonaiskolesterolia (30% - 46%), LDL -kolesterolia (41% - 61%), apolipoproteiini B: tä (34% - 50%) ja triglyseridejä (14% - 33) Nämä tulokset ovat yhdenmukaisia potilailla, joilla on heterotsygoottinen familiaalinen hyperkolesterolemia, ei-perheperäinen hyperkolesterolemia ja sekamuotoinen hyperlipemia, mukaan lukien potilaat, joilla on insuliinista riippumaton diabetes mellitus.
Kokonaiskolesterolin, LDL-kolesterolin ja apolipoproteiini B: n vähenemisen on osoitettu vähentävän sydän- ja verisuonitapahtumien riskiä ja sydän- ja verisuonikuolleisuutta.
Homotsygoottinen perheperäinen hyperkolesterolemia
Kahdeksan viikkoa kestäneessä monikeskustutkimuksessa, joka sisälsi valinnaisen jatkovaiheen vaihtelevalla pituudella, 335 potilasta otettiin mukaan, joista 89 sairasti homotsygoottista perinnöllistä hyperkolesterolemiaa. Näistä 89 potilaasta LDL -kolesterolin keskimääräinen prosentuaalinen lasku oli noin 20%. Atorvastatiinia annettiin enintään 80 mg: n vuorokausiannoksina.
Ateroskleroosi
Käänteisessä ateroskleroosissa, jossa oli aggressiivinen lipidejä alentava tutkimus (REVERSAL), arvioitiin intensiivisen lipidipitoisuutta alentavan 80 mg atorvastatiinihoidon ja 40 mg pravastatiinin tavanomaisen lipidipitoisuutta alentavan hoidon vaikutusta sepelvaltimon ateroskleroosiin intravaskulaarisella ultraäänellä (IVUS). angiografia potilailla, joilla on sepelvaltimotauti. Tässä satunnaistetussa, kaksoissokkoutetussa, monikeskuksisessa, kontrolloidussa kliinisessä tutkimuksessa IVUS suoritettiin 502 potilaalla lähtötilanteessa ja 18 kuukauden kuluttua. Ateroskleroosin etenemistä ei havaittu atorvastatiiniryhmässä (n = 253).
Keskimääräinen prosentuaalinen muutos ateroman kokonaistilavuudessa (päätutkimuksen tavoite) lähtötilanteesta oli -0,4% (p = 0,98) atorvastatiiniryhmässä ja + 2,7% (p = 0,001) pravastatiiniryhmässä (n = 249). atorvastatiinin ja pravastatiinin välillä oli tilastollisesti merkitsevä (p = 0,02). Tässä tutkimuksessa ei arvioitu aggressiivisen lipidejä alentavan hoidon vaikutusta kardiovaskulaarisiin päätetapahtumiin (esim. Revaskularisaation tarve, ei-kuolemaan johtava sydäninfarkti, sepelvaltimokuolema).
Atorvastatiiniryhmässä LDL -kolesteroli laski keskimäärin 2,04 mmol ± 0,8 (78,9 mg / dL ± 30) lähtötasosta 3,89 mmol / L ± 0,7 (150 mg / dL ± 28) ja pravastatiiniryhmässä LDL -kolesteroli laski keskiarvoon 2,85 mmol / L ± 0,7 (110 mg / dL ± 26) lähtötilanteesta 3,89 mmol / L ± 0,7 (150 mg / dL ± 26) (pPCR 36,4% atorvastatiiniryhmässä verrattuna 5,2 % laskua pravastatiiniryhmässä (s
Tutkimuksen tulokset saatiin 80 mg: n annoksella, joten niitä ei voida ekstrapoloida pienempiin annoksiin.
Turvallisuus- ja siedettävyysprofiilit olivat vertailukelpoisia näiden kahden hoitoryhmän välillä.
Tässä tutkimuksessa ei tutkittu lipidien vähenemisen vaikutusta ensisijaisiin kardiovaskulaarisiin päätetapahtumiin, joten näiden löydösten kliinistä merkitystä primaaristen ja sekundaaristen sydän- ja verisuonitapahtumien ehkäisyyn ei tunneta.
Akuutti sepelvaltimo-oireyhtymä
MIRACL-tutkimuksessa atorvastatiinia 80 mg arvioitiin 3086 potilaalla (atorvastatiini n = 1538; lumelääke n = 1548), joilla oli akuutti sepelvaltimotauti (ei-Q-sydäninfarkti tai epästabiili angina pectoris) .Hoito aloitettiin akuutin vaiheen aikana sairaalahoidon jälkeen ja kesti 16 viikon ajan. Atorvastatiinihoito 80 mg / vrk lisäsi yhdistetyn ensisijaisen päätetapahtuman alkamisaikaa, joka määritellään kuolemaksi mistä tahansa syystä, ei-kuolemaan johtava sydäninfarkti, sydämenpysähdys ja elvytys tai angina pectoris, johon liittyy todisteita sydäniskemiasta vaatii sairaalahoitoa, mikä osoittaa 16% riskin pienenemisen (p = 0,048). Tämä johtui pääasiassa siitä, että angina pectoriksen sairaalahoitoriskin riski pieneni 26% ja todettiin sydänlihasiskemia (p = 0,018). Muut toissijaiset päätetapahtumat eivät saavuttaneet erikseen tilastollista merkitsevyyttä (yleisesti: lumelääke: 22,2%; atorvastatiini: 22,4%)
Atorvastatiinin turvallisuusprofiili MIRACL -tutkimuksessa oli kohdassa 4.8 kuvatun profiilin mukainen.
Sydän- ja verisuonitautien ehkäisy
Atorvastatiinin vaikutusta kuolemaan johtavaan ja ei-kuolemaan johtavaan sepelvaltimotautiin arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa, Anglo-Scandinavian Cardiac Outcomes Trial Lipid Lowering Arm (ASCOTT-LLA). Potilaat olivat hypertensiivisiä, 40–79 -vuotiaita, ilman aiempaa sydäninfarktia tai angina pectoriksen hoitoa ja kokonaiskolesterolipitoisuus (CT) ≤ 6,5 mmol / l (251 mg / dl). Kaikilla potilailla oli vähintään 3 ennalta määritetystä sydän- ja verisuonitautitekijästä: miehen sukupuoli, ikä ≥ 55 vuotta, tupakointi, diabetes, sepelvaltimotauti ensimmäisen asteen sukulaisessa, CT: HDL-C> 6, perifeerinen verisuonisairaus, vasemman kammion hypertrofia , aiempia aivoverisuonitapahtumia, erityisiä EKG -muutoksia, proteinuriaa / albuminuriaa.
Potilaita hoidettiin verenpainelääkkeellä (amlodipiini- tai atenololipohjainen hoito-ohjelma) ja atorvastatiinilla 10 mg / vrk (n = 5168) tai lumelääkkeellä (n = 5137).
Atorvastatiinin vaikutus absoluuttiseen ja suhteelliseen riskin vähenemiseen oli seuraava:
1 Perustuu 3,3 vuoden mediaaniseurantajakson aikana tapahtuneisiin raa'an tapahtuman esiintyvyyseroihin.
CDH = sepelvaltimotauti; MI = sydäninfarkti
Kokonaiskuolleisuus ja sydän- ja verisuonikuolleisuus eivät vähentyneet merkittävästi (185 vs. 212 tapahtumaa, p = 0,17 ja 74 vs. 82 tapahtumaa, p = 0,51). Sukupuoleen perustuvissa alaryhmäanalyyseissä (81% miehiä, 19% naisia) atorvastatiinin myönteinen vaikutus havaittiin miehillä, mutta sitä ei voitu todeta naisilla, mikä johtuu mahdollisesti naisten alaryhmän alhaisista tapahtumista. Kokonais- ja sydän- ja verisuonikuolleisuus olivat numeerisesti korkeammat naisilla (38 vs. 30 ja 17 vs. 12), mutta tämä ei ollut tilastollisesti merkitsevää. Verenpainetta alentavan hoidon vuoksi hoidossa oli merkittävä vuorovaikutus lähtötilanteessa. Ensisijainen päätetapahtuma (kuolemaan johtava CHD ja ei-kuolemaan johtava MI) pieneni merkittävästi atorvastatiinilla potilailla, jotka saivat amlodipiinia (HR 0,47 (0,32--0,69) p = 0,00008), mutta ei atenololilla hoidetuilla (HR 0,83 (0,59--1,17) ), p = 0,287).
Atorvastatiinin vaikutusta kuolemaan johtavaan ja ei-kuolemaan johtavaan sydänsairauteen arvioitiin myös monikeskustutkimuksessa, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa, Collaborative Atorvastatin Diabetes Study (CARDS), joka tehtiin tyypin 2 diabetesta sairastavilla potilailla. 75 vuotta, ilman aiempaa sydän- ja verisuonisairautta ja LDL-kolesteroli ≤ 4,14 mmol / l (160 mg / dl) ja TG ≤ 6,78 mmol / l (600 mg / dl). Kaikilla potilailla oli vähintään yksi seuraavista riskitekijöistä: kohonnut verenpaine, jatkuva tupakointi, retinopatia, mikroalbuminuria tai makroalbuminuria.
Potilaita hoidettiin atorvastatiinilla 10 mg / vrk (n = 1428) tai lumelääkkeellä (n = 1410) keskimääräisen seuranta-ajan 3,9 vuoden ajan.
Atorvastatiinin vaikutus absoluuttiseen ja suhteelliseen riskin vähenemiseen oli seuraava:
1 Perustuu 3,9 vuoden seuranta-ajanjakson aikana tapahtuneisiin raakatapahtumien eroihin.
AMI = akuutti sydäninfarkti, CHD = sepelvaltimotauti, CABG = sepelvaltimon ohitusleikkaus, MI = sydäninfarkti, PTCA = perkutaaninen transluminaalinen sepelvaltimoiden leikkaus
Hoitovaikutuksessa ei havaittu eroja sukupuolen, iän tai lähtötilanteen LDL-kolesterolipitoisuuden suhteen. Kuolleisuusasteessa havaittiin positiivinen suuntaus (82 kuolemaa lumelääkeryhmässä ja 61 kuolemaa atorvastatiiniryhmässä, p = 0,0592).
Toistuva aivohalvaus
SPARCL -tutkimuksen aikana (Aivohalvauksen ehkäisy vähentämällä aggressiivisesti kolesterolitasoja), atorvastatiinin 80 mg kerran vuorokaudessa tai lumelääkkeen vaikutuksia aivohalvaukseen arvioitiin 4731 potilaalla, joilla oli ollut aivohalvaus tai ohimenevä iskeeminen kohtaus (TIA) viimeisten 6 kuukauden aikana ja joilla ei ollut aiemmin ollut sepelvaltimotautia. potilaista oli 21-92 -vuotiaita miehiä (keski -ikä 63), ja LDL -arvo oli lähtötilanteessa keskimäärin 133 mg / dl (3,4 mmol / l). Keskimääräinen LDL -arvo oli 133 mg / dl (3,4 mmol / l). - C oli 73 mg / dl (1,9 mmol / l) atorvastatiinihoidon aikana ja 129 mg / dl (3,3 mmol / l) plasebohoidon aikana. Seurannan mediaani oli 4,9 vuotta.
Atorvastatiini 80 mg pienensi kuolemaan johtavan tai ei-kuolemaan johtavan aivohalvauksen ensisijaisen päätetapahtuman riskiä 15% (HR 0,85; 95% CI, 0,72-1,00; p = 0,05 tai 0,84; 95% CI, 0,71-0,99; p = 0,03 Kaikista syistä kuolleisuus oli 9,1% (216/2365) atorvastatiinilla verrattuna 8,9% (211/2366) lumelääkkeeseen.
Post-hoc-analyysi osoitti, että 80 mg atorvastatiinia vähensi iskeemisen aivohalvauksen ilmaantuvuutta (218/2365, 9,2% vastaan 274/2366, 11,6%, p = 0,01) ja lisäävät verenvuotohäiriöitä (55/2365, 2,3%) vastaan 33/2366, 1,4%, p = 0,02) verrattuna lumelääkkeeseen.
• Verenvuotohalvauksen riski kasvoi tutkimukseen osallistuneilla potilailla, joilla oli aiempi verenvuotohäiriö (7/45 atorvastatiinia) vastaan 2/48 plasebo; HR 4,06; 95%: n luottamusväli, 0,84--19,57) ja iskeemisen aivohalvauksen riski on samanlainen molemmissa ryhmissä (3/45 atorvastatiini) vastaan 2/48 plasebo; HR 1,64; 95%: n luottamusväli, 0,27 - 9,82).
• Hemorragisen aivohalvauksen riski kasvoi tutkimukseen osallistuneilla potilailla, joilla oli aikaisempi lakunaarinen infarkti (atorvastatiini 20/708) vastaan 4/701 plasebo; HR 4,99; 95%: n luottamusväli, 1,71-14,61), mutta iskeemisen aivohalvauksen riski pieneni myös näillä potilailla (79/708 atorvastatiini) vastaan 102/701 plasebo; HR 0,76; 95% CI, 0,57-1,02). Aivohalvauksen nettoriski voi olla suurempi potilailla, joilla on aiemmin ollut lakunaarinen infarkti ja jotka ottavat atorvastatiinia 80 mg kerran vuorokaudessa.
Kaikista syistä kuolleisuus oli 15,6% (7/45) atorvastatiiniryhmässä verrattuna 10,4%: iin (5/48) potilaiden alaryhmässä, joilla oli aiemmin verenvuotohäiriö. Kaikista syistä johtuva kuolleisuus oli 10,9% (77/708) atorvastatiinilla ja 9,1% (64/701) lumelääkkeellä potilaiden alaryhmässä, jolla oli aiemmin lakunaarinen infarkti.
Pediatriset potilaat
Heterotsygoottinen perheperäinen hyperkolesterolemia 6-17-vuotiailla lapsipotilailla
Atorvastatiinin farmakokinetiikkaa, farmakodynamiikkaa sekä turvallisuutta ja siedettävyyttä arvioitiin kahdeksan viikon avoimessa tutkimuksessa lapsilla ja nuorilla, joilla on geneettisesti vahvistettu heterotsygoottinen perinnöllinen hyperkolesterolemia ja lähtötilanteen LDL-kolesteroli ≥ 4 mmol / l. Mukaan otettiin 39 lasta ja nuorta, 6–17-vuotiasta. Ryhmään A kuului 15 6–12-vuotiasta lasta ja Tanner-vaihe 1. Ryhmään B kuului 24 lasta 10–17-vuotiaille lapsille ja Tanner-vaihe ≥ 2.
Atorvastatiinin aloitusannos oli yksi 5 mg: n purutabletti päivässä ryhmässä A ja yksi 10 mg: n tabletti päivässä ryhmässä B.
LDL -kolesterolin, kokonaiskolesterolin, VLDL -kolesterolin ja apolipoproteiini B: n keskiarvot laskivat viikolla 2 kaikilla koehenkilöillä. Tutkittavilla, joilla annos kaksinkertaistettiin, havaittiin lisävähennyksiä jo toisen viikon alussa, ensimmäinen arvio annoksen suurentamisen jälkeen. Lipidiparametrien keskimääräinen prosentuaalinen lasku oli samanlainen molemmissa ryhmissä riippumatta siitä, pysyivätkö koehenkilöt aloitusannoksella vai kaksinkertaistivatko aloitusannoksen. Viikolla 8 LDL: n ja kokonaiskolesterolin prosentuaalinen muutos lähtötilanteesta oli keskimäärin 40% ja 30% koko lääkkeen altistusalueella.
Heterotsygoottinen perheperäinen hyperkolesterolemia 10–17-vuotiailla lapsipotilailla
Kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa, jota seurasi avoin vaihe, 187 poikaa ja tyttöä (kuukautisten jälkeinen vaihe), 10-17-vuotiaat (keski-ikä 14,1 vuotta), joilla oli heterotsygoottinen perheperäinen hyperkolesterolemia (FH) tai vaikea hyperkolesterolemia satunnaistettiin saamaan atorvastatiinihoitoa (n = 140) tai lumelääkettä (n = 47) 26 viikon ajan ja sen jälkeen kaikkia atorvastatiinilla 26 viikon ajan. Atorvastatiinin annos (kerran vuorokaudessa) oli 10 mg ensimmäisten 4 viikon ajan ja sen jälkeen vähitellen 20 mg, jos LDL -kolesterolitaso oli> 3,36 mmol / l. Atorvastatiini laski merkittävästi plasman kokonaiskolesterolia, LDL-kolesterolia, triglyseridejä ja apolipoproteiini B: tä 26 viikon kaksoissokkoutetussa vaiheessa. Keskimääräinen saavutettu LDL-kolesteroli oli 3,38 mmol / l (vaihteluväli: 1, 81-6,26 mmol / l) atorvastatiiniryhmä verrattuna 5,91 mmol / l (vaihteluväli: 3,93-9,96 mmol / l) lumelääkeryhmässä 26 viikon kaksivaiheisessa sokeassa.
Toinen atorvastatiinia ja kolestipolia koskeva pediatrinen tutkimus 10--18-vuotiailla potilailla, joilla oli hyperkolesterolemia, osoitti, että atorvastatiini (N = 25) aiheutti merkittävän LDL-kolesterolin vähenemisen viikolla 26 (p
Vaikeaa hyperkolesterolemiaa (mukaan lukien homotsygoottista hyperkolesterolemiaa) sairastavilla potilailla tehdyssä laajalti käyttöä koskevassa tutkimuksessa oli mukana 46 potilasta, jotka saivat atorvastatiinia titratulla hoitovasteella (jotkut potilaat saivat 80 mg atorvastatiinia vuorokaudessa). Tutkimus kesti. 3 vuotta: LDL -kolesteroli laski 36%.
Lasten atorvastatiinihoidon pitkäaikaista tehoa aikuisten sairastuvuuden ja kuolleisuuden vähentämisessä ei ole osoitettu.
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset atorvastatiinilla 0 -vuotiailla lapsilla ja heterotsygoottisen hyperkolesterolemian hoidolla sekä 0 ...
05.2 Farmakokineettiset ominaisuudet
Imeytyminen
Atorvastatiini imeytyy nopeasti oraalisen annon jälkeen; huippupitoisuus plasmassa (Cmax) saavutetaan 1-2 tunnin kuluessa. Imeytymisaste kasvaa suhteessa atorvastatiiniannokseen. Suun kautta annettuna kalvopäällysteisten tablettien hyötyosuus on 95% - 99% atorvastatiinin oraaliliuoksesta. Atorvastatiinin absoluuttinen hyötyosuus on noin 12% ja HMG-CoA-reduktaasia estävän aktiivisuuden systeeminen saatavuus on noin 30%. Alhainen systeeminen saatavuus johtuu ruoansulatuskanavan limakalvon esijärjestelmäpuhdistumasta ja / tai maksan ensikierron metaboliasta .
Jakelu
Atorvastatiinin keskimääräinen jakautumistilavuus on noin 381 litraa. Atorvastatiini sitoutuu 98% tai enemmän plasman proteiineihin.
Aineenvaihdunta
Atorvastatiini metaboloituu sytokromi P450 3A4: n kautta orto- ja parahydroksyloiduiksi johdannaisiksi ja erilaisiksi beetahapetustuotteiksi. Muiden metaboliareittien lisäksi nämä tuotteet metaboloituvat myös glukuronidaation kautta. Para-hydroksyloidut metaboliitit vastaavat atorvastatiinin metaboliaa. Noin 70% HMG-CoA-reduktaasin kiertävästä estävästä aktiivisuudesta johtuu aktiivisista metaboliiteista.
Erittyminen
Atorvastatiini eliminoituu pääasiassa sappeen maksan ja / tai maksan ulkopuolisen metabolian jälkeen.Lääke ei kuitenkaan näytä käyvän merkittävää enterohepaattista kierrätystä. Ihmisillä atorvastatiinin keskimääräinen eliminaation puoliintumisaika plasmassa on noin 14 tuntia. HMG -CoA -reduktaasia estävä aktiivisuus on noin 20-30 tuntia aktiivisten metaboliittien vaikutuksen vuoksi.
Erityisryhmät
Iäkkäät potilaat: Atorvastatiinin ja sen aktiivisten metaboliittien pitoisuudet plasmassa terveillä vanhuksilla ovat korkeammat kuin nuorilla aikuisilla, kun taas vaikutukset lipideihin ovat verrattavissa nuoremmilla potilailla havaittuihin.
Pediatriset potilaat:
8 viikkoa kestäneessä avoimessa tutkimuksessa 6-17-vuotiaat lapsipotilaat, Tanner-vaihe 1 (n = 15) ja Tanner-vaihe ≥2 (n = 24), joilla oli heterotsygoottinen perheperäinen hyperkolesterolemia ja lähtötilanteen LDL-kolesteroli ≥ 4 mmol / l hoidettiin kerran vuorokaudessa 5 mg atorvastatiinilla tai 10 mg purutabletilla tai 10 mg atorvastatiinilla tai 20 mg kalvopäällysteisellä tabletilla. Paino oli ainoa merkittävä kovariantti atorvastatiinin populaatiofarmakokineettisessä mallissa. LDL-kolesterolin ja kokonaiskolesterolin huomattavaa laskua havaittiin atorvastatiinille ja o-hydroksiatorvastatiinille altistumisen annosalueella.
Kuulumisen sukupuoli: Atorvastatiinin ja sen aktiivisten metaboliittien pitoisuudet naisilla eroavat miesten pitoisuuksista (naiset: Cmax noin 20% korkeampi ja AUC noin 10% pienempi). Näillä eroilla ei ollut kliinistä merkitystä, eivätkä ne johtaneet eroihin. Kliinisesti merkittäviä vaikutuksia lipideihin miehet ja naiset.
Munuaisten vajaatoiminta: Munuaissairaus ei vaikuta atorvastatiinin ja sen aktiivisten metaboliittien pitoisuuteen eikä lipidejä alentaviin vaikutuksiin.
Maksan vajaatoiminta: Atorvastatiinin ja sen aktiivisten metaboliittien pitoisuudet plasmassa suurenevat merkittävästi (noin 16 kertaa Cmax ja noin 11 kertaa AUC) potilailla, joilla on krooninen alkoholisairaus (Child-Pugh B).
SLOC1B1 -polymorfismi: Kaikkien HMG-CoA-reduktaasin estäjien, mukaan lukien atorvastatiini, maksan ottoon liittyy OATP1B1-kuljettaja. Rabdomyolyysiriski (ks. Kohta 4.4). OATP1B1-koodatun geenin (SLCO1B1 c.521CC) polymorfismi liittyy 2,4 kertaa suurempaan atorvastatiinialtistukseen (AUC) ) kuin yksilöillä, joilla ei ole genotyypin varianttia (c.521TT). Geneettisesti riittämätön atorvastatiinin imeytyminen on myös mahdollista näillä potilailla. Mahdollisia vaikutuksia tehoon ei tunneta.
05.3 Prekliiniset tiedot turvallisuudesta
Atorvastatiinilla oli negatiivinen mutageeninen ja klastogeeninen potentiaali neljässä in vitro -testissä ja yhdessä in vivo -määrityksessä.Atvastastatiini ei ollut karsinogeeninen rotilla, mutta suuret annokset hiirillä (tuloksena 6-11 kertaa AUC0-24h, joka saavutettiin ihmisillä suurimmat suositellut annokset) osoittivat maksasolujen adenoomia miehillä ja hepatosellulaarisia karsinoomia naisilla.
Kokeelliset eläinkokeet ovat osoittaneet, että HMG-CoA-reduktaasin estäjät voivat vaikuttaa alkion kehitykseen tai sikiöön. Rotilla, kaneilla ja koirilla atorvastatiini ei vaikuttanut hedelmällisyyteen eikä ollut teratogeeninen, mutta annoksilla, joiden uskotaan olevan äidille toksisia, havaittiin sikiötoksisuutta rotilla ja kaneilla. äideille suurille atorvastatiiniannoksille. Rotilla on näyttöä istukan leviämisestä.Rottien atorvastatiinipitoisuudet plasmassa ovat samanlaiset kuin maidossa.Ei tiedetä, erittyykö atorvastatiini tai sen metaboliitit maitoon.
06.0 FARMASEUTTISET TIEDOT
06.1 Apuaineet
Tabletin ydin
Kalsiumkarbonaatti (E170)
Mikrokiteinen selluloosa (E460)
Laktoosimonohydraatti
Kroskarmelloosinatrium
Polysorbaatti 80 (E433)
Hyproloosi (E463)
Magnesiumstearaatti (E572)
Päällystyskalvo
Hypromelloosi (E464)
Makrogoli 8000
Titaanidioksidi (E171)
Talkki (E553b)
Simetikoni
Stearaattiset emulgointiaineet
Sakeutusaineet (metyyliselluloosa, ksantaanikumi)
Bentsoehappo
Sorbiinihappo
06.2 Yhteensopimattomuus
Ei oleellinen.
06.3 Voimassaoloaika
3 vuotta.
06.4 Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
06.5 Välipakkauksen luonne ja pakkauksen sisältö
Läpipainopakkaus, jossa 4, 7, 10, 14, 20, 28, 30, 50, 56, 84, 90, 98, 100 kalvopäällysteistä tablettia.
Pakattu HDPE-pulloon, jossa on 90 kalvopäällysteistä tablettia.
Sairaalapakkaukset, joissa on 84, 100, 200 (10x20) tai 500 kalvopäällysteistä tablettia.
Läpipainopakkaukset, jotka koostuvat polyamidi / alumiini- ja polyvinyylikloridilevystä ja alumiinitiivistelevystä, jossa on vinyyli-kuumasaumauslakka.
HDPE-pullo sisältää kuivausainetta ja siinä on lapsiturvallinen suljin, jossa on puristettava ja kierrettävä korkki.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
06.6 Käyttö- ja käsittelyohjeet
Ei erityisiä ohjeita.
07.0 MYYNTILUVAN HALTIJA
Pfizer Limited, Ramsgate Road, Sandwich, Kent CT13 9NJ, Yhdistynyt kuningaskunta
Italian edustaja:
Pfizer Italia S.r.l. - Via Isonzo 71 04100 Latina
08.0 MYYNTILUVAN NUMERO
TORVAST 10 mg kalvopäällysteiset tabletit
10 tablettia 10 mg - A.I.C. n: 033007016 / M
30 tablettia 10 mg - A.I.C. n ..: 033007028 / M
90 tablettia 10 mg - A.I.C. n. 033007079 / M
TORVAST 20 mg kalvopäällysteiset tabletit
10 tablettia 20 mg - A.I.C. n: 033007030 / M
30 tablettia 20 mg - A.I.C. n: 033007042 / M
90 tablettia 20 mg - A.I.C. n. 033007081 / M
TORVAST 40 mg kalvopäällysteiset tabletit
10 tablettia 40 mg - A.I.C. n: 033007055 / M
30 tablettia 40 mg - A.I.C. n: 033007067 / M
90 tablettia 40 mg - A.I.C. n. 033007093 / M
TORVAST 80 mg kalvopäällysteiset tabletit
4 tablettia 80 mg - A.I.C. n. 033007244 / M
7 tablettia 80 mg - A.I.C. n. 033007257 / M
10 tablettia 80 mg - A.I.C. n. 033007269 / M
14 tablettia 80 mg - A.I.C. n. 033007271 / M
20 tablettia 80 mg - A.I.C. n. 033007283 / M
28 tablettia 80 mg - A.I.C. n. 033007295 / M
30 tablettia 80 mg - A.I.C. n. 033007307 / M
50 tablettia 80 mg - A.I.C. n. 033007319 / M
56 tablettia 80 mg - A.I.C. n. 033007321 / M
84 tablettia 80 mg - A.I.C. n. 033007333 / M
98 tablettia 80 mg - A.I.C. n. 033007345 / M
100 tablettia 80 mg - A.I.C. n. 033007358 / M
200 tablettia 80 mg - A.I.C. n. 033007360 / M
500 tablettia 80 mg - A.I.C. n. 033007372 / M
90 tablettia 80 mg HDPE -pullossa A.I.C. n. 033007384 / M
09.0 MYYNTILUVAN TAI UUDISTAMISPÄIVÄMÄÄRÄ
Torvast 10 mg, 20 mg, 40 mg:
Myyntiluvan myöntämispäivämäärä: 5. kesäkuuta 1997
Viimeisimmän uudistamisen päivämäärä: 25. huhtikuuta 2007
Torvast 80 mg:
Myyntiluvan myöntämisen päivämäärä: 5. huhtikuuta 2007
Viimeisimmän uudistamisen päivämäärä: 25. huhtikuuta 2007
10.0 TEKSTIN MUUTTAMISPÄIVÄMÄÄRÄ
Lokakuuta 2012